聯絡我們
Luana Med. B.V.
聯絡電話 : +31 6 2025 4033
電子郵件 : Info@luanamed.com
地址 : Weena-Zuid 130, 3012NC Rotterdam, Netherlands
Basic UDI-DI vs. UDI-DI
UDI (Unique Device Identification,單一識別碼),是為了醫療器材識別而產出的一串英數字。
導入UDI目的是為了能掌握醫療器材的生命週期;無論是生產過程、運輸、銷售、病患實際使用階段等,甚至在臨床上發生安全問題時,也能在短時間內識別、採取適當措施。
目前推行UDI已經是全球趨勢,不只美國已於2022年9月全面要求輸美醫療器材都需要有UDI系統;在2017/745中也明確地提及:
“The UDI system should apply to all devices placed on the market except custom-made devices, and be based on internationally recognised principles including definitions that are compatible with those used by major trade partners.”
也就是說,除了客製化產品以外,所有的醫療器材都應制定UDI,才允許在歐盟市場流通。
UDI的組成
UDI是一串數字英文,由兩個部分組成:
Device Identifier (UDI-DI) + Production Identifier (UDI-PI)
UDI-DI是對應特定型號/包裝配置的數字英文,只要沒有設計變更,就會是一個「固定」的字串。
UDI-PI會連動到生產資訊,像是批號、有效日期、製造日期或版次等,隨批次改變。
一般而言,在製造生產前已制定UDI-DI,而生產後才會獲得UDI-PI;後續會以UDI-DI為代表作進一步說明。
不同型號可以共用UDI-DI嗎?
每一個型號都應該有獨立的UDI-DI。除此之外,MDCG-2018-1 Rev.4提及:
“A new UDI-DI shall be required whenever there is a change that could lead to misidentification of the device and/or ambiguity in its traceability. In particular, a new UDI-DI shall be required in the case of any change of the following elements: name or trade name, device version or model, labelled as single use, packaged sterile, need for sterilization before use, quantity of devices provided in a package, critical warnings or contra-indications (e.g. containing latex or DEHP), CMR/Endocrine disruptors.”
也就是說產品發生變更,像是改變了名稱、商標、版本型號、標籤資訊(單次使用、滅菌狀態、特殊警示等資訊),為了避免誤用(misidentification),應給予另一組UDI-DI以作為區別。
例如:
塑膠針筒5mL可以編為UDI-DI #1,而體積增加為10mL時,需另給予編號,如UDI-DI #2。
UDI-DI主要強調能夠追蹤與產品識別,須貼於最小產品包裝上;然而在準備技術文件(TD)時,則需配合使用Basic UDI-DI來做管理。
Basic UDI-DI是什麼?
MDCG-2018-1 Rev.4說到:
“The scope of EU technical documentation assessment certificates, EU type-examination certificates and EU product verification certificates shall include, together with the Basic UDI-DI, a clear identification, including the name, model and type, of the device or devices, the intended purpose, as included by the manufacturer in the instructions for use and in relation to which the device has been assessed in the conformity assessment procedure and the risk classification.”
顯示在歐盟證書上要呈現的會是Basic UDI-DI,而並非UDI-DI。
參考MDCG-2018-1 Rev.4對於Basic UDI-DI定義:
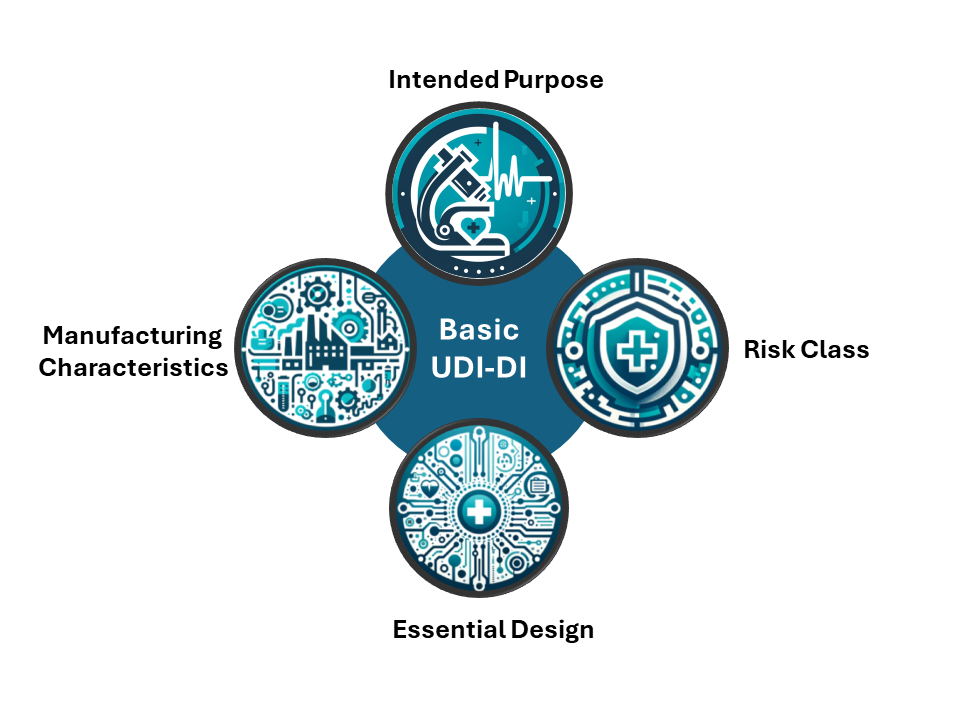
“The Basic UDI-DI is the main key in the database and relevant documentation (e.g. certificates, declaration of conformity, technical documentation and summary of safety and clinical performance) to connect devices with same intended purpose, risk class and essential design and manufacturing characteristics.”
意即Basic UDI-DI是在各個資料庫及文件中(像是證書、DoC、技術文件或者臨床性能與安全摘要等),串聯具有相同預期用途、風險等級、基本設計和製造特徵之醫療器材的「主要關鍵」。
Basic UDI-DI是針對一個產品類別的識別碼(identifier),可涵蓋多個系列或型號的產品,可想像成系列產品,或者產品家族的概念。例如,塑膠針筒5mL與10mL有個別的UDI-DI,但可能隸屬相同的Basic UDI-DI之下。
Basic UDI-DI是針對一個產品類別的識別碼(identifier),可涵蓋多個系列或型號的產品,可想像成系列產品,或者產品家族的概念。例如,塑膠針筒5mL與10mL有個別的UDI-DI,但可能隸屬相同的Basic UDI-DI之下。
Basic UDI-DI和UDI-DI之間的關係為何?
參閱2017/745 Annex VI,Part C,有更多關於UDI System的要求,其中Basic UDI-DI與UDI-DI有著截然不同的概念:
Basic UDI-DI可以涵蓋不同的型號、尺寸、顏色等,而單一型號包裝則有自己的UDI-DI,形成一對多的關係,如同參考MDCG-2018所說的:
“A UDI-DI shall be associated with one and only one Basic UDI-DI”
我們也可透過下圖來理解兩者關係:

兩者之間還有以下差異:
| ITEM | Basic UDI-DI | UDI-DI |
|---|---|---|
| 涵蓋範圍 | Product family | Single pack configuration |
| 編碼系統 | GMN (Global Model Number) | GTIN (Global Trade Item Number) |
| 組成 | 公司碼+型號碼+檢核碼(最多25字) | 全球交易品項識別碼GTIN AI(01)* |
| 印製條碼要求 | 無 | 有,需為實體條碼或資料載體 |
| 使用包裝 | 無 | 於最小產品包裝及以上各層級包裝 |
| 用途 | 需引用於歐盟證書、符合性聲明與技術文件 | 供應鏈間追蹤,如出貨、標籤等 |
*以GS1標準為說明。
Basic UDI-DI跟UDI-DI可互換嗎?
不行!
Basic UDI-DI編碼與歐盟證書、技術文件等資料連結,並登錄於EUDAMED上,而UDI-DI則需印出條碼或資料載體,貼附於最小包裝上。兩者的意義不同,也不可互換。
由誰來制定UDI呢?
Basic UDI-DI & UDI-DI 的編碼結構中,含有公司前置碼、商品代碼以及檢核碼等資訊,其中作為唯一識別之編號的「公司前置碼」,必須向公認機構(如GS1、HIBCC、ICCBBA、以及IFA GmbH)來申請公司碼登記服務,無法自行創建。
而其餘的代碼,可由製造商依據產品資訊自行編制,並搭配公認機構軟體(例如GS1使用的GMN系統)獲得檢核碼,同時驗證。
以GS1為例說明編碼結構:
- Basic UDI-DI (不超過 25 碼)

- UDI-DI (GTIN14,不超過14碼)

參考資料:財團法人中華民國商品條碼策進會
Luana Med. B.V.
聯絡電話 :+31 15 222 0009
+31 6 2025 4033
電子郵件 :Info@luanamed.com
地址: 2627 AL, Delft, Netherlands
重要連結
COPYRIGHT(c) FROM luanamed |本網站建議使用Chrome,IE Edge和Safari瀏覽器瀏覽|Design by anyway 網頁設計



