注意:確定產品的正確分類,是製造商責任。若製造商為產品聲明多種預期用途,導致該器材屬於多個分類,則應採用較高分類。或者多條分類規則適用於同一器材,則應採用導致較高分類的規則。
聯絡我們
Luana Med. B.V.
聯絡電話 : +31 6 2025 4033
電子郵件 : Info@luanamed.com
地址 : Weena-Zuid 130, 3012NC Rotterdam, Netherlands
體外診斷醫療器材(IVDR)的分類分級,與IVDD截然不同的風險概念
在2017 年,歐盟推出了兩項新法規,其中體外診斷醫療器材法EU 2017/746 (IVDR),取代原先的體外診斷醫療器材指令(IVDD)。
與IVDD最巨大的差異,是IVDR重新定義了「體外診斷醫療器材」的風險等級和分類依據。在IVDD時代被列為自我宣告的產品,超過90%在IVDR被列入NB的管轄範圍,大幅增加了監管強度,對製造商來說是全然不同的挑戰。
甚麼是體外診斷醫療器材?
Article 2(2)對於「體外診斷醫療器材(In vitro Diagnostic Device」定義是:
任何作為試劑、試劑產品、校準品、控制材料、試劑盒、儀器、設備、裝置、軟體或系統的醫療器材,不論單獨使用或組合使用,且其由製造商設定的用途為在體外檢查來自人體的樣本(包括血液和組織捐贈物),僅或主要為提供以下一項或多項資訊:
- 有關生理或病理過程或狀態;
- 有關先天性身體或心理缺陷;
- 有關醫學狀況或疾病的傾向;
- 用於確定與潛在受者的安全性和相容性;
- 用於預測治療反應或反應;
- 用於定義或監控治療措施。
樣本容器(specimen receptacle)也應視為體外診斷醫療器材。
注意:IVDR特別提到「樣本容器」,根據Article 2(3),樣本容器是為一種裝置,不論是否為真空型,由製造商特別設計用於初步收納和保存來自人體的樣本,以供體外診斷檢查之用,所以也被視為是IVD的一體。
IVDR 分類標準實施規則(Implementing Rules)
討論ANNEX VIII的分類規則前,有幾項通用原則的概念必須建立:
- 分類規則的應用應以器材的預期用途為依據。若產品與其他器材/配件組合使用,則分類規則應分別適用於每個器材/配件。也就是說,每個器材/配件的分類,應根據其自身的特性和風險進行獨立評估,而不是統一按照整個系統的最高分類進行歸類。
- 對於軟體類產品,包含單獨使用或與其他器材搭配使用,通稱為醫療器材軟體(Medical device software, MDSW),若MDSW搭配其他醫療器材結合使用,應該與搭配產品歸為同一分類。若為單獨使用,則應根據其預期用途進行獨立分類。
- 用於校準器材的校準品(calibrator),應歸為與該器材相同的分類。
- 具有定量或定性指定值,且用於特定分析物(單一或多個)的對照品(control)應歸為與該器材相同的分類。

基於風險的IVD分類
首先,當產品符合IVD定義,屬於「體外診斷醫療器材」時,即可透過IVDR ANNEX VIII的分類規則(Rule 1-7),依據產品的預期用途(intended use)按風險等級由低至高,分為 Class A、B、C 和 D:
Class A - 病人和公共衛生風險低,包括樣本容器、實驗室儀器和緩衝溶液。
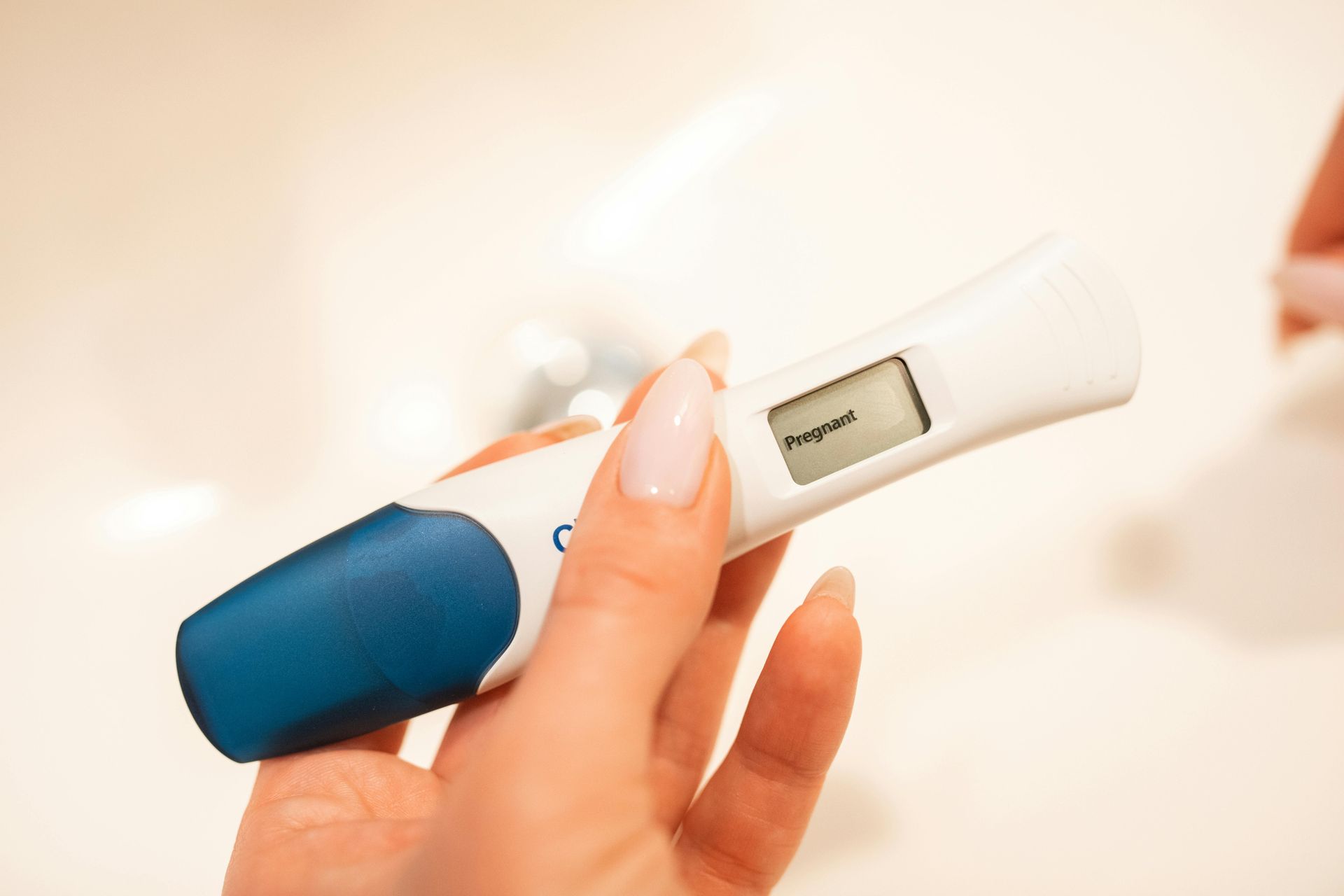
Class B - 中度病患風險和/或低公共衛生風險,包括用於自我檢測(Self-testing devices)的 IVD,常見例如驗孕棒、排卵檢測試紙等,或者任何其他規則未涵蓋的 IVD 的預設分類(見ANNEX VIII Rule 6說明)。
Class C - 高病患風險和/或中等公共衛生風險,包括用於檢測沒有高傳播風險的傳染性病原體,或用於檢測錯誤時下可能導致死亡或嚴重殘疾的結果。
Class D - 高病患風險與高公共衛生風險,檢測或暴露於危及生命的傳染媒介或具有高傳播風險的傳染媒介和傳染病的 IVD,例如Covid-19檢測的試劑。
風險等級分類基於IVD的用途和對患者的潛在風險,也影響到監管機構對於產品上市前後的監管力道
例如:Class A、Class B級產品上市之後,透過上市後監督報告(PMS Report)進行追蹤;對於高風險的Class C與Class D產品,要求提交定期安全更新報告(PSUR),詳見Article 80與Article 81。
例如:符合性評鑑流程中,Class D產品需通過歐盟參考實驗室(reference laboratory),並定期進行市場監測以確保安全。
由於風險等級決定了審查的嚴格程度,Class C 和 Class D產品也比需更長審查時間。
特殊類型產品
依據產品使用方法/目的/類型不同,有三類特殊類型:Self-testing (自我檢測)、Near-patient testing (NPT) (近病患檢測)、Companion diagnostics (CDx) (伴隨診斷),簡單敘述如下:
Self-testing devices (自我檢測器材)_Article 2 (5)
- 指製造商預定供非專業人員(一般民眾)使用的任何IVD。
- 這類IVD通常用於家中進行健康狀態的初步檢測或監測。例如:血糖測試儀等,由於使用者限定一般民眾,產品設計上需要特別強調使用安全性,並提供清晰的操作指引。
Near-patient testing (NPT) devices (近病患檢測器材)_Article 2 (6)
- 指非用於自我檢測,但設計用於在實驗室環境外進行檢測的IVD,通常由醫療專業人士在患者附近或身邊進行檢測。
- 這類器材主要用於醫護人員或訓練過的操作者在病患附近進行快速診斷或測試,通常適用於需要即時結果的情況。例如:急診室中使用的血氣分析儀或床旁檢測設備。設計會考量快速性與方便性,以提高臨床效率。
Companion diagnostics (CDx) devices (伴隨診斷器材)_Article 2 (6)
- 指對應醫藥產品安全有效使用所必需的IVD,用於以下目的之一:
(a) 在治療之前和/或期間,識別最有可能從對應醫藥產品中受益的患者;
(b) 在治療之前和/或期間,識別因使用對應醫藥產品治療而可能面臨嚴重不良反應風險增加的患者。 - 此類IVD專為確定某種治療是否適用於特定患者而設計,常與特定藥物一起使用。例如:某些針對HER2 檢測的乳腺癌伴隨診斷,用於檢測 HER2 基因過度表達或擴增,幫助判定醫生判斷患者是否適合使用Herceptin藥物治療。

CDx通常需要與藥物開發同步進行,並接受更嚴格的審查,因為它直接影響患者的治療效果。
結語
在 IVDD時代,大多數廠商都透過自我宣告完成符合性路徑,無需透過NB審查獲得CE標誌。
當IVDR來臨,部分過去未被IVDD納管或者是被列為自我宣告的產品,將被IVDR列入NB的管轄範圍。實際上,除了Class A非無菌產品,絕大部分的IVD的符合性路徑都需要NB參與。
過去熟悉IVDD的製造商,在轉換為IVDR或規劃新產品上市的過程中,可能會忽略了不同的符合性路徑造成上市時程和費用的巨大差異。
所以即刻起,請放下過去IVDD的想法,重新檢視手上的IVD產品,透過分類原則完成分類判定,就是迎接IVDR的第一步!
Luana Med. B.V.
聯絡電話 :+31 15 222 0009
+31 6 2025 4033
電子郵件 :Info@luanamed.com
地址: 2627 AL, Delft, Netherlands
重要連結
COPYRIGHT(c) FROM luanamed |本網站建議使用Chrome,IE Edge和Safari瀏覽器瀏覽|Design by anyway 網頁設計



