5分鐘搞清楚MDR過渡期條款(MDD展延),到底誰適用?
2023 Jun 21
Chou Chih-Hsuan, Senior Regulation Affair
歐盟執委會於2023年3月公布了2023/607,以說明MDD架構下的醫療器材如何於展延方案中受益,目標在解決由於NB發證數量不足造成的醫療器材短缺。
本文主要說明哪些產品及情況適用於2023/607,並提供一個簡易的判別方式。
此過渡期只適用於Legacy Device
Legacy Device是指在2021年5月21日前,根據90/385/EEC和93/42/EEC所頒發的證書或符合性聲明(DoC)所涵蓋的產品。
原有MDD證書的到期日是關鍵
2023/607中列出了幾個關鍵的日期,讓製造商根據此資訊判斷如何讓證書持續有效。
轉版計畫以及與NB的協議是必要條件
由於2023/607無意延遲整個MDR的適用期限,因此製造商須在期限內與NB簽定轉版協議,以確保製造商在可即時符合MDR的規範。
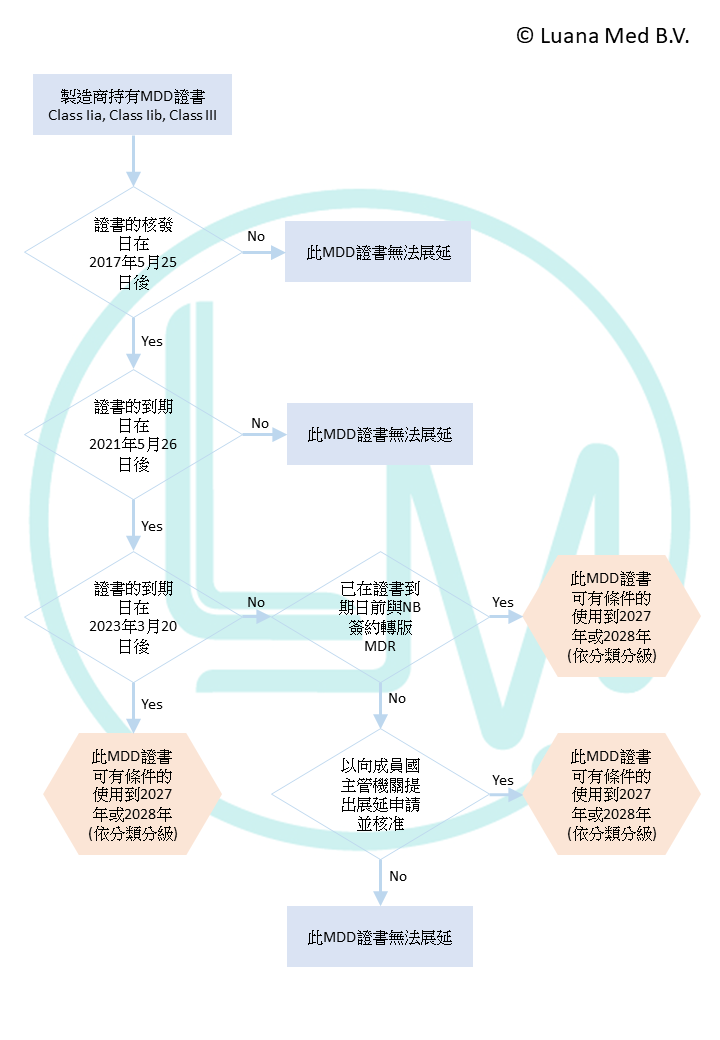
若根據以上的圖表,您的MDD證書可展延,恭喜您!然而展延使用MDD證書的條件為何?要注意哪些事?可參考以下文章:符合MDR過渡期資格的MDD證書,可用到何時?有哪些注意事項?
若您需要向歐盟成員國主管機關提出申請才有可能獲得展延核准,可與我們聯絡,Luana Med提供專業的付費諮詢,協助您取得與主管機關溝通的機會,進一步獲得展延的可能。