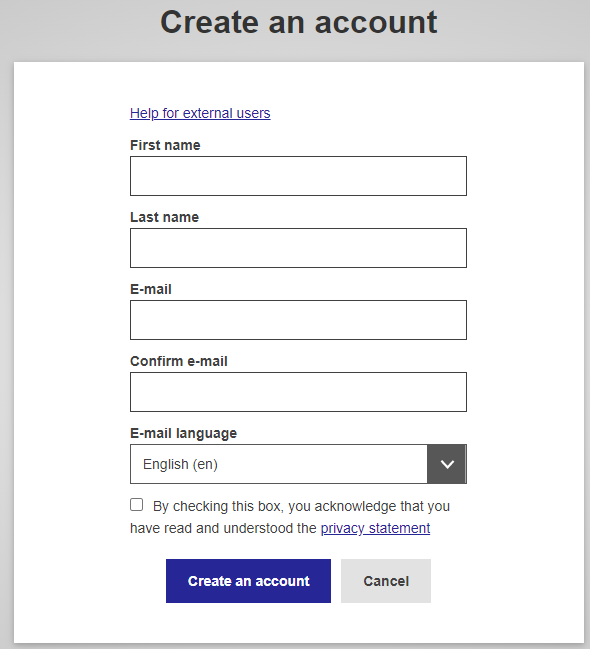
- First name / Last name–填入姓名 (備註:須為natural person)
- E-mail–填入電子郵件
- Confirm e-mail–再次填入電子郵件
- E-mail language–通知信的語言設定
- Check the privacy statement–隱私權設定聲明
EU login帳號申請步驟
2023 Apr 30
Chen Jen-Ru
建立EU login帳號
- 填入基本資料
- 完成後按下Create an account,系統會寄一封通知信到您的電子郵件中,按下信中連結
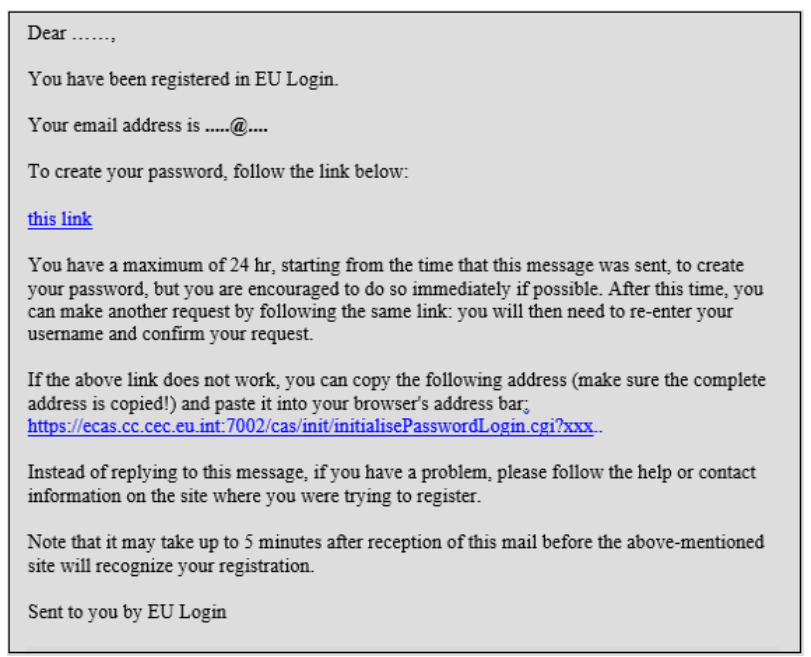
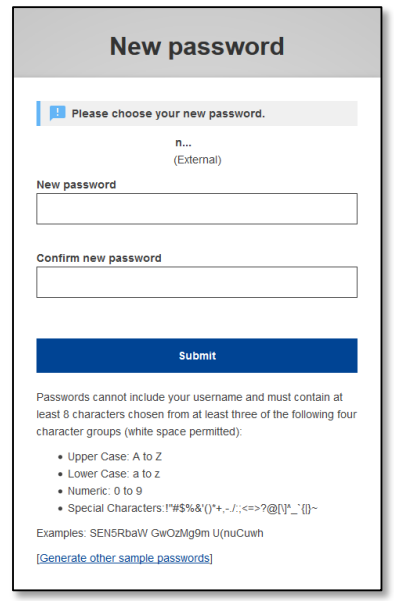
- 跳出密碼設定畫面-密碼必須包含大小寫及特殊字元,至少10字。按下Submit,即可完成EU login申請。
Author
&
Co-author
Chen Jen-Ru
Y. H.